Актуальность проблемы эффективного и безопасного медикаментозного лечения воспалительных заболеваний кишечника (ВЗК), таких как болезнь Крона (БК) и язвенный колит (ЯК), не оставляет сомнений. Особую категорию больных составляют беременные, поскольку пик заболеваемости ВЗК отмечается между 20 и 30 годами жизни и приходится на период деторождения [1]. По данным Европейской организации по изучению болезни Крона и язвенного колита (European Crohn’s and Colitis Organisation, ECCO), фертильность, то есть способность зачать ребенка, у женщин с ВЗК такая же, как и у здоровых женщин, за исключением пациенток с выраженной активностью воспалительного процесса, непрерывно рецидивирующим течением заболевания, перенесших хирургическую резекцию с формированием илеоанального резервуарного анастомоза (ИАРА) [2]. Однако в литературе имеются достаточно разнородные данные о частоте бесплодия у женщин с ВЗК — от 5–14%, что соответствует частоте бесплодия в общей популяции, до 32–42% [1, 3]. Кроме того, интерпретация результатов исследований фертильности при ВЗК осложняется тем обстоятельством, когда больные осознанно решают не планировать беременность, и именно эта «добровольная бездетность» затрудняет анализ данных [4].
Главный вопрос, который беспокоит женщин с ВЗК, планирующих беременность, — будут ли лекарственные средства, которые они принимают, оказывать неблагоприятное воздействие на плод [4–6]. Недостаточная информированность пациенток может привести, с одной стороны, к несоблюдению режима дозирования или полному прекращению приема лекарственных препаратов, с другой стороны — к принятию решения о прерывании беременности в случае ее возникновения [1, 4, 6–8]. В связи с этим врач должен иметь четкое представление о медикаментозных средствах для лечения ВЗК, об их преимуществах и существующих возможных рисках как для матери, так и для плода. Тактика ведения беременной с ВЗК выбирается индивидуально в каждом конкретном случае.
Главная цель медикаментозной терапии ВЗК — достижение и поддержание ремиссии, не только клинико-лабораторной, но и морфологической (эндоскопической и гистологической) [4, 9–13]. Установлено, что прекращение лечения ВЗК и развитие на этом фоне обострения представляют больший вред для плода, чем продолжение терапии любыми препаратами [14, 15].
Прогресс в изучении молекулярных механизмов воспаления при ВЗК способствовал значительному прорыву в области консервативного лечения БК и ЯК — появлению биологической терапии [15, 16]. Согласно клиническим рекомендациям Российской гастроэнтерологической ассоциации (РГА) и Ассоциации колопроктологов России (АКР), биологические агенты используются только при среднетяжелом и тяжелом течении БК и ЯК, как в качестве монотерапии, так и в комбинации с другими противовоспалительными препаратами [17]. Биологические препараты позволяют быстро достичь стойкой клинико-лабораторной, морфологической ремиссии ВЗК, в том числе и во время беременности [18–24].
В этой обзорной статье будут проанализированы имеющиеся данные о преимуществах и недостатках биологической терапии в лечении ВЗК во время беременности (табл.).
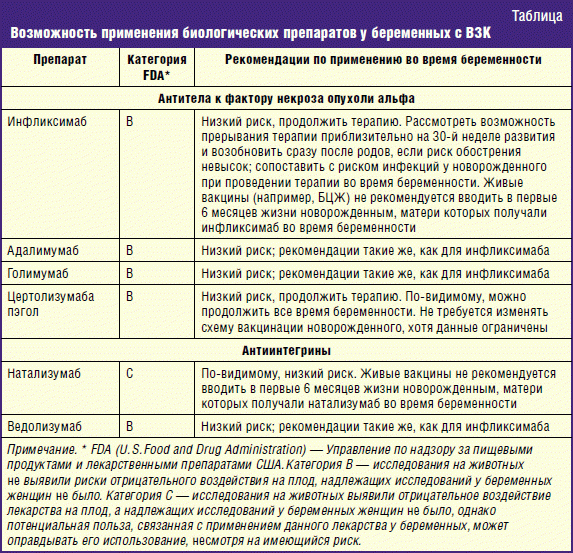
В лечении ВЗК используются биологические препараты, ингибирующие ключевую молекулу воспаления — антитела к фактору некроза опухоли альфа (инфликсимаб, адалимумаб, голимумаб) и блокирующие экспрессию так называемых «молекул адгезии» — антиинтегрины (натализумаб, ведолизумаб) [1, 3, 11, 13].
По данным регистра PIANO, применение биологических препаратов вплоть до третьего триместра беременности у пациенток с ВЗК не повышало риска аномалий плода, спонтанных абортов, задержки внутриутробного развития или дефицита массы тела при рождении [21]. Известно, что молекулы большинства препаратов данной группы слишком большие, чтобы проникнуть через плаценту, тем не менее, плацента способна активно накапливать и переносить существенное количество всех биологических препаратов (за исключением цертолизумаба пэгол) в кровоток плода в третьем триместре беременности [22, 25].
Инфликсимаб представляет собой химерные IgG1 моноклональные антитела, состоящие из человеческого и мышиного компонентов, адалимумаб и голимумаб — полностью гуманизированные человеческие антитела [4, 11]. Антитела к фактору некроза опухоли альфа (ФНО-альфа) связывают и нейтрализуют данный провоспалительный цитокин, фиксируют комплемент и индуцируют апоптоз Т-клеток, а также тормозят миграцию лейкоцитов [16]. Эти препараты не проникают через плацентарный барьер в первый триместр беременности, но обнаруживаются в организме плода во втором и третьем триместре, а также в крови новорожденного в течение 6 месяцев после рождения [4, 11]. Поэтому эти препараты, как правило, не рекомендуют принимать после 30-й недели беременности, если достигнута ремиссия, чтобы избежать неонатальной иммуносупрессии [1]. Если ремиссия не достигнута, препараты можно принимать и в третий триместр, но только если угроза для жизни матери превышает все имеющиеся риски для плода [26]. Частота развития неблагоприятных исходов беременности (самопроизвольный аборт, преждевременные роды, врожденные аномалии и задержка внутриутробного развития плода) у пациенток с ВЗК, получавших инфликсимаб, аналогична таковым у беременных женщин с ВЗК, не получающих терапию препаратами анти-ФНО-альфа [27]. В регистре PIANO отсутствуют указания на повышение риска развития инфекции у новорожденных, матери которых лечились инфликсимабом, кроме тех случаев, когда инфликсимаб применялся в комбинации с азатиоприном [21]. Однако в литературе имеется описание случая смертельной инфекции после введения вакцины БЦЖ ребенку, подвергшемуся внутриутробному воздействию инфликсимаба [28]. Учитывая этот факт, не рекомендуется вводить живые аттенуированные вакцины новорожденным в течение 6 месяцев после рождения, пока биологический препарат еще может циркулировать в организме [1].
Исследования адалимумаба, проведенные на животных моделях, не указывают на повышенный акушерский риск или тератогенный эффект [19]. Препарат активно переносится через плаценту, тем не менее, нет сведений о врожденных аномалиях плода у беременных женщин, получавших адалимумаб [21].
Информации о безопасности применения голимумаба во время беременности недостаточно, данных о его применении у обозначенной категории женщин в настоящее время нет. В экспериментальных исследованиях репродуктивной функции животных на фоне применения голимумаба нежелательные явления отмечены не были [20].
Цертолизумаба пегол (ЦЗП) является пегилированным Fab-фрагментом гуманизированного анти-ФНО-альфа моноклонального антитела. Этот Fab-фрагмент проникает через плаценту путем пассивной диффузии, поэтому концентрация препарата в пуповинной крови плода гораздо ниже, в отличие от инфликсимаба, адалимумаба или голимумаба, и не обнаруживается в плазме крови новорожденного [22, 25]. Анализ течения 47 беременностей на фоне терапии ЦЗП, по регистру PIANO, показал отсутствие нежелательных последствий для плода [21]. Однако необходимы дополнительные данные, чтобы полностью оценить безопасность и переносимость препарата [20]. Тем не менее, в настоящее время ЦЗП рассматривается как наиболее оптимальный биологический препарат для беременной с ВЗК, особенно в третьем триместре [22].
Натализумаб представляет собой гуманизированные IgG4 антитела против молекулы адгезии — α4-интегрин [1]. В отношении применения натализумаба у беременных сведений не достаточно. Ранее сообщалось, что у обезьян при введении дозы, в 2,3 раза больше рекомендуемой для человека, вызывает анемию, тромбоцитопению, атрофию печени, селезенки и тимуса [29]. В проспективном наблюдении за течением 13 беременностей у женщин с рассеянным склерозом, получавших натализумаб в третьем триместре, были выявлены легкие и среднетяжелые гематологические нарушения у 10 из 13 детей [18]. В инструкции к препарату указано, что натализумаб следует применять во время беременности только в том случае, если потенциальная польза для матери оправдывает потенциальный риск для плода. Однако следует отметить, что пока на территории Российской Федерации препарат имеет только одно показание для применения — рассеянный склероз.
Ведолизумаб — препарат нового поколения, в 2014 г. одобрен для лечения ВЗК в США и странах Евросоюза, в 2016 г. — в России [30, 31]. Представляет собой рекомбинантные антитела IgG1, которые связываются с α4β7-интегрином и блокируют миграцию лейкоцитов селективно в стенке кишечника, чем препятствуют развитию воспалительного процесса [31]. Этот препарат аналогично анти-ФНО проникает через плаценту, концентрация линейно нарастает с течением беременности, достигая максимума в третьем триместре [4]. Нет тератогенного действия у животных, подвергавшихся воздействию высоких доз ведолизумаба, в 20 раз превышающих рекомендуемые дозы у человека [4]. На сегодняшний день данные о безопасности применения ведолизумаба у беременных женщин отсутствуют, однако создан регистр исходов беременности [32].
Заключение
Резюмируя вышесказанное, следует сделать вывод о том, что биологическая терапия может использоваться во время беременности, учитывая ее высокую эффективность и относительную безопасность. Следует помнить, что выбор оптимального препарата для биологической терапии и сроков проведения самой терапии должны рассматриваться в отношении каждого конкретного пациента с учетом всех возможных рисков как со стороны матери, так и со стороны плода.
Литература
- Gaidos J. K. J., Kane S. V. Sexuality, Fertility, and Pregnancy in Crohn’s Disease // Gastroenterology Clinics of North America. 2017. Vol. 46 (3). P. 531–546.
- Van der Woude C. J. The Second European Evidenced-Based Consensus on Reproduction and Pregnancy in Inflammatory Bowel Disease // Journal of Crohn’s and Colitis. 2015. Vol. 9 (2). P. 107–124.
- Hosseini-Carroll P., Mutyala M., Seth A. et al. Pregnancy and inflammatory bowel diseases: Current perspectives, risks and patient management // World Journal Gastrointestinal Pharmacology and Therapeutics. 2015. Vol. 6 (4). P. 156–171.
- Gaidos J. K. J., Kane S. V. Managing IBD Therapies in Pregnancy // Current Treatment Options in Gastroenterology. 2017. Vol. 15 (1). P. 71–83.
- Парфенов А. И. Воспалительные заболевания кишечника и беременность // Экспериментальная и клиническая гастроэнтерология. 2012. № 3. С. 80–86.
- Ellul P., Zammita S. C., Katsanos K. H. et al. Perception of Reproductive Health in Women with Inflammatory Bowel Disease // Journal of Crohn’s and Colitis. 2016. Vol. 10 (8). P. 886–891.
- Gallinger Z. R. et al. Perceptions and Attitudes Towards Medication Adherence during Pregnancy in Inflammatory Bowel Disease // Journal of Crohn’s and Colitis. 2016. Vol. 10 (8). P. 892–897.
- Maliszewska A. M. et al. Infammatory bowel disease and pregnancy // Ginecologia Polska. 2017. Vol. 88 (7). P. 398–403.
- Ахмедов В. А., Ливзан М. А. Заболевания желудочно-кишечного тракта у беременных [Электронный ресурс]. М.: ГЭОТАР-Медиа, 2016.
- Циммерман Я. С., Михалева Е. Н. Возможности фармакотерапии при лечении гастроэнтерологических заболеваний в период беременности // Клиническая медицина. 2015. № 8. С. 8–18.
- Kanis S. L., van der Woude C. J. Proper Use of Inflammatory Bowel Disease Drugs during Pregnancy // Digestive Diseases. 2016. Vol. 34 (1). P. 61–66.
- Nielsen O. H., Maxwell C., Hendel J. IBD medications during pregnancy and lactation // Nat. Rev. Gastroenterol. Hepatol. 2014. Vol. 11 (2). P. 116–127.
- Poturoglu S., Ormeci A. C., Duman A. E. Treatment of pregnant women with a diagnosis of inflammatory bowel disease // World Journal Gastrointestinal Pharmacology and Therapeutics. 2016. Vol. 7 (4). P. 490–502.
- Еремина Е. Ю., Пунгина М. Ю. Воспалительные заболевания кишечника и беременность // Проблемы женского здоровья. 2013. Т. 8 (3). С. 77–86.
- Лазебник Л. Б. и др. Биологическая терапия воспалительных заболеваний кишечника // Экспериментальная и клиническая гастроэнтерология. 2011. № 2. С. 7–14.
- Фиокки К. Этиопатогенез воспалительных заболеваний кишечника // Колопроктология. 2015. № 1 (51). С. 5–20.
- Халиф И. Л. Изменения в клинических рекомендациях по диагностике и лечению больных ВЗК // Гастроэнтерология. 2017. № 4. С. 20–26.
- Friend S., Richman S., Bloomgren G. et al. Evaluation of pregnancy outcomes from the Tysabri® (natalizumab) pregnancy exposure registry: a global, observational, follow-up study // BMC Neurology. 2016. Vol. 16 (1). P. 150.
- Khan N., Asim H., Lichtenstein G. R. Safety of anti-TNF therapy in inflammatory bowel disease during pregnancy // Expert opinion on Drug Safety. 2014. Vol. 13 (12). P. 1699–1708.
- Komoto S., Motoya S., Nishiwaki Y. et al. Pregnancy outcome in women with inflammatory bowel disease treated with anti-tumor necrosis factor and or thiopurine therapy: a multicenter study from Japan // Intestinal Reserch. 2016. Vol. 14 (2). P. 139–145.
- Mahadevan U., Martin C. F., Sandler R. S. et al. PIANO: a 1000 patient prospective registry of pregnancy outcomes in women with IBD exposed to immunomodulators and biologic therapy // Gastroenterology. 2012. Vol. 142 (5). Suppl. 1. P. S-149.
- Mariette X. еt al. Lack of placental transfer of certolizumab pegol during pregnancy: results from CRIB, a prospective, postmarketing, pharmacokinetic study // Ann. Rheum. Dis. 2017. Vol. 10. P. 1–6.
- Paramichael K., Mantzaris G. J., Peyrin-Biroulet L. A safety assessment of anti-tumor necrosis factor alpha therapy for treatment of Crohn’s disease // Expert opinion on Drug Safety. 2014. Vol. 15 (4). P. 493–501.
- Weber-Schoendorfer C. et al. Pregnancy outcome after TNF-α inhibitor therapy during the first trimester: a prospective multicentre cohort study // British Journal of Clinical Pharmocology. 2015. Vol. 80 (4). P. 727–739.
- Mahadevan U., Wolf D. C., Dubinsky M. et al. Placental transfer of anti-tumor necrosis factor agents in pregnant patients with inflammatory bowel disease // Clin. Gastroenterol. Hepatol. 2013. Vol. 11 (3). P. 286–292.
- De Lima A. et al. Tailored anti-TNF therapy during pregnancy in patients with IBD: maternal and fetal safety // Gut. 2016. Vol. 65 (8). P. 1261–1268.
- Gisbert J. P., Chaparro M. Review Safety of anti-TNF agents during pregnancy and breastfeeding in women with inflammatory bowel disease // The American Journal of Gastroenterolog. 2013. Vol. 108 (9). P. 1426–1438.
- Heller M. M., Wu J. J., Murase J. E. Fatal case of disseminated BCG infection after vaccination of an infant with in utero exposure to infliximab // J. Am. Acad. Dermatol. 2011. Vol. 65 (4). P. 870.
- Haqhikia A., Langer-Gould A., Rellensmann G. et al. Natalizumab use during the third trimester of pregnancy // JAMA Neurol. 2014. Vol. 71 (7). P. 891–895.
- Серпик В. Г. Анализ регистрации лекарственных средств в России // Современная организация лекарственного обеспечения. 2016. № 3–4. С. 10–19.
- Халиф И. Л., Шапина М. В. Применение ведолизумаба при воспалительных заболеваний кишечника // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016. Т. 26, № 6. С. 92–100.
- Mahadevan U., Vermeire S., Lasch K. et al. Vedolizumab exposure in pregnancy: outcomes from clinical studies in inflammatory bowel disease // Alimantary Pharmocology and Therapeutics. 2017. Vol. 45 (7). P. 941–950.
В. А. Ахмедов, доктор медицинских наук, профессор
Т. С. Жаброва
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
1 Контактная информация: v_akhmedov@mail.ru
Возможности применения биологической терапии при воспалительных заболеваниях кишечника на фоне беременности/ О. В. Гаус, В. А. Ахмедов, Т. С. Жаброва
Для цитирования: Лечащий врач № 2/2018; Номера страниц в выпуске: 38-40
Теги: биологические препараты, воспаление, рецидивирующее течение
Купить номер с этой статьей в pdf