Часть 2. Начало статьи читайте в № 4, 2016 г.
Провокационные тесты
В соответствии с рекомендациями, разработанными специалистами EAACI/GA2LEN, из-за отсутствия безопасных высокочувствительных и специфичных тестов in vitro в диагностический алгоритм включается провокационный тест, поскольку он является важным компонентом окончательной диагностики. Однако с клиническими целями диагностические провокационные тесты проводятся ограниченному контингенту больных — только той группе, которым НПВП необходимы для лечения сопутствующих хронических заболеваний. Любые провокационные тесты с Аспирином проводятся только больным с ОФВ
Для диагностики Н/АОРБ рекомендуются:
- оральный простой слепой плацебо-контролируемый провокационный тест с Аспирином;
- ингаляционный простой слепой плацебо-контролируемый провокационный тест с растворимыми формами АСК (lysine-aspirin, L-ASA);
- назальный простой слепой плацебо-контролируемый провокационный тест с lysine-aspirin (L-ASA).
При проведении провокационного теста in vitro используют прием Аспирина внутрь с последующим мониторированием показателей бронхиальной проходимости. Типовая схема дозируемого теста с ацетилсалициловой кислотой включает прием первоначальной дозы 3 мг, при отсутствии изменений со стороны ФВД дозу Аспирина увеличивают постепенно: 30, 60, 100, 150, 325, 650 мг. Интервал между приемом каждой дозы составляет 3 часа. Тест считают положительным, если ОФВ1 или пиковая объемная скорость выдоха (ПОС) снижаются не менее чем на 15% в сочетании с симптомами бронхообструкции и раздражением носа и глаз. При отсутствии этих клинических данных тест считают положительным при снижении показателей ОФВ1 или ПОС не менее чем на 20%. При появлении признаков развивающейся реакции последующее введение ацетилсалициловой кислоты прекращают и проводят активную терапию с бронхолитиками.
После перенесенной реакции наступает 2–5-дневный рефрактерный период, в течение которого у больного имеется толерантность к АСК и другим НПВП.
Типичный ответ на Аспириновую провокацию представлен на рис. 4.
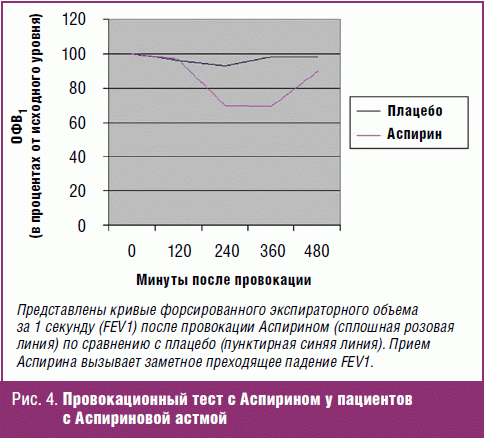
В рекомендациях [56] представлены протоколы оральной, бронхиальной и назальной провокаций Аспирином.
Ингаляционные тесты с водорастворимыми формами АСК — Аспирин-лизин (ацетилсалицилат лизина аспизол) являются более безопасными. Интраназальная проба менее чувствительна, но более безопасна, чем ингаляционная, может рассматриваться как процедура первоначальной оценки астмы с непереносимостью НПВП при Н/АОРБ.
При положительных провокационных тестах и появлении симптомов бронхиальной обструкции больному назначают быстродействующие бета2-агонисты через дозированный аэрозольный ингалятор (2–4 вдоха) или через небулайзер (например, 2,5–5,0 мг сальбутамола) до тех пор, пока уровень ОФВ1 не достигнет 90% от исходного уровня. При тяжелых реакциях назначают ГКС перорально или внутривенно в дозе, эквивалентной 40 мг преднизолона. Анафилактические реакции требуют немедленного введения адреналина и проведения мероприятий в соответствии со стандартом терапии при анафилактическом шоке.
Провокационные тесты осуществляются не только с Аспирином, но и другими НПВП, большинство из которых используют перорально. Кроме того, предложен тест с кеторолаком, который можно вводить внутривенно с заданной скоростью, внутримышечно или путем интразального, интраконъюнктивального применения.
Лабораторные тесты
Для подтверждения диагноза предлагаются тесты с определением уровня цистеиновых лейкотриенов, но они требуют дальнейшего обоснования как в случае IgE-зависимых, так и при IgE-независимых реакциях. Определение базального ЛТЕ4 в моче не является диагностическим маркером Аспириновой непереносимости, провокация Аспирином увеличивает уровень ЛТЕ4 в моче и у здоровых лиц. Также не оправдал себя тест изолированного высвобождения лейкотриенов из лейкоцитов периферической крови после провокации, поскольку различий между Аспирин-чувствительными и Аспирин-толерантными пациентами получено не было [57].
Большую чувствительность и специфичность продемонстрировал ASPITest — Aspirin Sensitive Patients Identification Test. Значимость определения Аспирин-индуцированного образования 15-НЕТЕ в лейкоцитах периферической крови (ELISA для определения эйкозаноидов после инкубации лейкоцитов с лизин-Аспирином, напроксеном) продолжает анализироваться [15, 58].
Для диагностики in vitro Н/АОРБ был предложен тест базофильной активации (БАТ) с измерением экспрессии на мембране базофилов маркерной молекулы CD63 после провокации. Однако специфичность и чувствительность были вариабельными, поэтому тесты не могли рассматриваться как надежные диагностические подходы [59, 60].
В своих ранних работах по изучению роли тромбоцитов [38] мы обнаружили, что наиболее яркой отличительной способностью тромбоцитов, выделенных из крови пациентов с Аспириновой астмой, было аномальное изменение внутриклеточного уровня цАМФ при АДФ-индуцированной агрегации в отличие от пациентов с атопией. Кроме того, тромбоциты больных с гиперчувствительностью к НПВП, обусловленной неиммунологическими феноменами, были слабочувствительны к действию агонистов, но высокочувствительны к действию ингибиторов агрегации, что рассматривалось как признак четкой дифференциальной диагностики неиммунологической гиперчувствительности к НПВП.
Как потенциальные серологические биомаркеры для определения фенотипа Н/AОРБ рассматриваются сывороточный периостин и дипептидил пептидаза 10 (dipeptidyl peptidase 10, DPP10) [61].
Лечение
Достижение и поддержание контроля астмы при Н/АОРБ должно осуществляться с позиций обновленных клинических рекомендаций, где основными препаратами для лечения фенотипа тяжелой астмы являются иГКС или комбинированные препараты [48–51, 62].
Нередко из-за тяжести течения процесса лечение сразу начинается с назначения системных кортикостероидов в комбинации с интраназальными кортикостероидными препаратами. В настоящее время спектр противовоспалительных препаратов для лечения Аспириновой астмы расширился за счет антилейкотриеновых препаратов (АЛТП).
Терапия полипозного риносинусита в соответствии с национальными рекомендациями [63] и европейской позицией специалистов EP3 OS [52] предполагает интенсивное их лечение у больных с Н/АОРБ. Назальные стероиды должны назначаться достаточно активно и в должной дозировке для того, чтобы добиться прекращения роста полипов и регресса процесса.
Рекомендуемая начальная дозировка иГКС в пересчете на беклометазон — не менее 100 мкг в каждую половину носа дважды в день (по 2 инсуффляции, или 2 дозы на каждое впрыскивание). При необходимости доза увеличивается в 2 раза. Современные иГКС (будесонид, флутиказона пропионат и фуроат, мометазона фуроат) доказали свою эффективность при лечении полипов [64, 65].
При неэффективности назальных форм проводится 5–7-дневный курс преднизолона в ежедневной дозе 30 мг. После уменьшения полипов после курса сГКС для профилактики рецидивов назначаются топические стероиды.
При сопутствующей инфекции носовых пазух проводится длительная антибиотикотерапия — адекватные дозы в течение 6–8 недель. Однако российская школа оториноларингологов рекомендует продолжительность курсовой антибактериальной терапии 10–20 дней [52, 63, 66].
Простое удаление полипов носа приводит лишь к временному облегчению симптомов обструкции, за которым, как правило, следует рецидив.
При хирургическом лечении больных могут быть использованы различные методы, однако само вмешательство должно всегда следовать принципам функциональности и минимальной инвазивности.
Хирургическое лечение проводится по следующим показаниям:
- сочетание полипоза и хронического риносинусита, не поддающегося терапии;
- наличие полной обструкции носовых ходов, создающей особый дискомфорт;
- сочетание полипов с персистирующим этмоидитом и закупоркой ячеек.
При синуситах, резистентных к антибиотикотерапии, может потребоваться хирургический дренаж.
Антилейкотриеновые препараты. Определение ключевой роли лейкотриенов в патогенезе Н/АОРБ расширило возможности для специфической и эффективной терапии указанного синдрома. Ингибиторы синтеза лейкотриенов, а также антагонисты лейкотриеновых рецепторов подавляют ответ на провокацию Аспирином [67, 68]. Дополнительное назначение монтелукаста к иГКС или иГКС/ДДБА приводит к значительному улучшению симптомов астмы в течение 12 месяцев у всех пациентов [69]. Антагонисты лейкотриенов эффективны также при полипозном риносинусите [70]. Таким образом, антилейкотриеновые препараты рассматриваются как препараты эффективной базисной, профилактической терапии, особенно при Н/АОРБ. АЛТП не используются для купирования острых приступов бронхиальной обструкции вместо бета2-агонистов.
В настоящее время для лечения астмы в США разрешены Управлением по контролю за продуктами питания и лекарственными средствами (Food and Drug Administration, FDA) три таких препарата: зилеутон, являющийся ингибитором 5-ЛО, зафирлукаст и монтелукаст — антагонисты ЛТД
Биологические молекулы. В современную клиническую практику активно внедряется целевая (или таргетная) терапия. В отличие от универсальных противовоспалительных препаратов (иГКС, АЛТП и т. п.) таргетные препараты способны изменить подходы к терапии астмы у отдельных групп пациентов. Проблема современной таргетной терапии именно в выборе цели. Поиск индивидуальных мишеней может привести к более совершенным клиническим исследованиям, выявлению новых биомаркеров и разработке новых методов лечения, направленных на определенные механизмы заболевания [71].
При Н/АОРБ были изучены омализумаб и меполизумаб [72]. Омализумаб (моноклональное тело против IgE) оказался полезным у больных с полипами носа. У 24 пациентов с хроническими полипозными риносинуситами и сопутствующей астмой, примерно половина из которых имели AERD, проведено лечение омализумабом. Субъекты получали от четырех до восьми подкожных доз препарата (n = 16) или плацебо (n = 8), в соответствии с принципами дозирования омализумаба для лечения астмы (на основании уровня сывороточного IgE и массы тела) [73]. Лечение омализумабом было связано с улучшением симптомов дыхательных путей и качества жизни, а также со значительным снижением общего количества эндоскопических носовых баллов полипоза через 16 недель по сравнению с плацебо. Изменения в течении полипоза были отчасти подтверждены с помощью компьютерной томографии (КТ) синусов и не зависели от наличия аллергии. Из-за малой выборки пока неясно, является ли данный эффект значимым для всех больных с Н/АОРБ. В двух клинических случаях у пациентов с AERD и тяжелой астмой использование омализумаба сопровождалось клиническим улучшением течения астмы и потерей чувствительности к АСК при оральной провокации [74]. Омализумаб был одобрен FDA для лечения недостаточно контролируемой среднетяжелой и тяжелой астмы и может рассматриваться как дополнительная терапия у пациентов с сопутствующим хроническим полипозным риносинуситом [75].
Меполизумаб (моноклональное антитело против ИЛ-5) был изучен у больных с тяжелой астмой и эозинофилией крови или мокроты с удовлетворительным результатом [76].
После двух месяцев лечения у 12 из 20 пациентов, получавших меполизумаб, отмечалось уменьшение полипов по сравнению с группой плацебо. Исследование имеет значительные ограничения, требуется дальнейшая оценка эффективности препарата с учетом эозинофильной природы астмы и носовых полипов у больных Н/АОРБ.
Десенситизация Аспирином
Больным, чувствительным к НПВП, которым эти препараты необходимы для лечения других заболеваний (ишемическая болезнь сердца, ревматические болезни и др.), проводят десенситизацию в условиях стационара под руководством специалиста [48, 77].
Проведение десенситизации осуществляется в соответствии с протоколом, который требует пребывания пациента в стационаре не менее 3 дней, в течение которых достигается максимально переносимая доза 600 мг Аспирина с продолжением последующего ежедневного приема указанной дозы в течение 2 лет.
Показания к проведению десенситизации:
- сопутствующие ревматологические заболевания у больных Аспириновой астмой (ревматоидный артрит или остеоартроз);
- необходимость угнетения агрегации тромбоцитов для профилактики ишемической болезни сердца при непереносимости НПВП;
- больные с Н/АОРБ тяжелой астмой и полипами, резистентные к фармакотерапии или имеющие побочные эффекты от терапии ГКС.
Противопоказания к проведению десенситизации:
- обострение бронхиальной астмы;
- кровоточивость;
- язвенная болезнь желудка и двенадцатиперстной кишки;
- тяжелые заболевания печени и почек;
- беременность.
При крапивнице, отеке, анафилаксии, вызванных приемом ацетилсалициловой кислоты или ее аналогов, десенситизация неэффективна.
Метод десенситизации основан на феномене развития толерантности больного с Аспириновой астмой к повторному воздействию НПВП в период 24–72 часов после удушья, вызванного приемом ингибиторов циклооксигеназы.
В первый день проведения десенситизации больной получает последовательно 3, 30 и 60 мг АСК, во второй — 100, 300 и 600 мг.
Указанные дозы АСК с учетом индивидуальной чувствительности назначаются каждые 3 часа, с таким же интервалом времени проводится мониторинг легочных симптомов и ФВД. При появлении реакции дозу, вызвавшую изменения состояния больного, повторяют после купирования бронхоспазма. При отсутствии реакции дозу увеличивают с 3-часовым интервалом до появления признаков реакции или до достижения дозы 600 мг АСК. Десенситизацию удается провести в течение 2, чаще 3 дней только у пациентов со стабильно протекающей астмой и только в условиях стационара, где имеются все необходимые условия для оказания неотложной помощи и интенсивного лечения.
При успешной десенситизации исчезает чувствительность и к другим НПВП. При приеме больным одной дозы ежедневно толерантность к НПВП может сохраняться неопределенно долго. При отмене препарата толерантность исчезает в течение 2–3 дней.
Десенситизация Аспирином позволяет контролировать симптомы астмы и риносинусита у пациентов с Аспириновой астмой и с этой целью используется в некоторых центрах для лечения больных с рефрактерным течением Н/АОРБ («астматической триады»).
Последние достижения в понимании механизмов и усовершенствованные протоколы сделали процедуру значительно безопаснее, и амбулаторная десенситизация Аспирином теперь является стандартом лечения [78].
Немедикаментозная терапия Н/А ОРБ. Для таких методов терапии, как акупунктура, гомеопатия, нет опубликованных результатов контролируемых испытаний. Эффективность этих методов, возможно, сопоставима с эффектом плацебо. До появления соответствующих клинических испытаний и документированных данных о долговременном улучшении при Н/АОРБ применять эти методы лечения не рекомендуется [49–51, 79].
Диета с низким содержанием салицилатов. Многие пищевые продукты содержат естественные салицилаты. Это фрукты и ягоды (абрикосы, апельсин, виноград, вишня, грейпфрут, дыня, клубника, малина, персики, слива, смородина черная, чернослив, яблоки), овощи (огурцы, перец, помидоры). Салицилаты присутствуют в меде, пиве, миндале, в консервированных продуктах, в том числе колбасах, буженине, ветчине. В домашних условиях ацетилсалициловая кислота часто используется в качестве консерванта при приготовлении солений, компотов и других продуктов для длительного хранения. До последнего времени рекомендации по их ограничению носили эмпирический характер, поскольку не было проведено доказательных исследований по поводу того, способствует ли их элиминация уменьшению частоты осложнений, сокращению длительности заболевания и улучшению исходов [80]. Однако недавно проведенное пилотное исследование с перекрестным дизайном, в котором пациенты были рандомизированы на две группы, получавшие в течение 6 недель обычную диету или с низким содержанием салицилатов, позволяет говорить о значимости диетического режима. Результаты экспериментального исследования свидетельствуют о том, что диета с низким содержанием салицилатов улучшает назальные симптомы и эндоскопическую картину полипозного риносинусита у пациентов с AERD [81]. Необходимы дальнейшие исследования, чтобы поддержать эти выводы.
Пациенты с Н/АОРБ часто сообщают о том, что алкогольные напитки вызывают симптомы со стороны верхних (заложенность носа и ринорея) и нижних (хрипы, одышка) дыхательных путей [82]. В анкетном опросе 59 пациентов с AERD, подтвержденным провокационным тестом с Аспирином, 83% сообщили о реакции дыхательных путей на различные алкогольные напитки в виде симптомов, как правило, развивающихся в течение часа после приема алкоголя [83]. Использовать подобные продукты больные с Н/АОРБ не должны.
Исключение НПВП и адекватная их замена. Ключевым компонентом для достижения контроля над симптомами Н/АОРБ является исключение использования НПВП. Наиболее безопасным для Аспирин-чувствительных пациентов препаратом из группы НПВП является ацетаминофен (пара-ацетаминофенол, или парацетамол). Это слабый ингибитор циклооксигеназы, он лишь в редких случаях может вызывать побочные реакции у Аспирин-чувствительных пациентов при применении в высоких дозах (1000 мг и более). При Аспирин-чувствительной астме реакции на парацетамол могут быть у 5%. Рекомендуется начинать прием с 1/2 табл. (250 мг). Кроме парацетамола к слабым ингибиторам циклооксигеназы, относительно безопасным и не вызывающим бронхоспазм при Аспириновой астме (за исключением особо чувствительных пациентов), относятся салицилат натрия, салицилат холина, салицилсалициловая кислота, трисалицилат магния холин, фенилбутазон. Врач любой специальности должен быть осторожным при назначении НПВП пациентам с Н/АОРБ. Сложности исключения НПВП для профилактики возможных нежелательных реакций при их использовании связаны с широтой их применения. Только в США ежегодно выписывается более 70 млн рецептов на НПВП, 14–20 млн пациентов принимают НПВП длительное время. В эти цифры не входят более 26 млрд таблеток в год, которые потребители покупают без рецепта. В Италии в 2002 г. было продано более 58,5 млн упаковок НПВП. В развитых странах НПВП получают 20–30% лиц пожилого возраста. Применение НПВП постоянно увеличивается. В связи с изложенным важная роль отводится разработке новых НПВП и отбору среди уже имеющихся препаратов средств с наибольшей избирательностью по отношению к ЦОГ-2. Селективность к ЦОГ-2 обеспечивает меньший риск развития побочных эффектов. При необходимости назначения пациентам с Н/АОРБ анальгезирующих, жаропонижающих препаратов тактика врача — выбор селективного препарата; начало лечения с ½ терапевтической дозы; пристальное врачебное наблюдение в течение минимум 1 часа после приема препарата.
Показатели селективности различных НПВП и их подразделение на группы представлены в табл.
Заключение
Респираторные болезни, которые обостряются при приеме Аспирина и НПВП, включают пациентов с астмой и хроническим полипозным риносинуситом и представляют особый фенотип (AERD, Н/АОРБ), диагностируемый у 5–20% всех пациентов, страдающих астмой. В основе развития синдрома лежит нарушение метаболизма арахидоновой кислоты с дисбалансом между провоспалительными и противовоспалительными медиаторами, усугубляющимся под действием ингибиторов ЦОГ-2.
Наличие основных клинических проявлений (астма, хронический полипозный риносинусит и указание в анамнезе на непереносимость НПВП) позволяет поставить диагноз Н/АОРБ. Однако для окончательного диагноза требуется проведение провокационного теста с Аспирином или другими НПВП. Астма у больных с синдромом Н/АОРБ более тяжелая, плохо контролируемая, требует более агрессивной терапии ГКС, также как и имеющийся полипозный риносинусит. Полезным дополнением к лечению являются антилейкотриеновые препараты.
Исключение НПВП является ключевым моментом профилактики обострений, однако элиминация ингибиторов ЦОГ-1 в реальной практике не всегда возможна, кроме того, есть группы пациентов в общем пуле больных с Н/АОРБ, которым требуется назначение Аспирина и НПВП по поводу других заболеваний (например, периодические головные боли, ишемическая болезнь сердца, ревматические процессы, остеоартрозы и т. п.). В таких случаях специалистами (аллергологами, пульмонологами) проводится десенситизация Аспирином, если не удается подобрать взаимозаменяемые препараты.
Спектр терапевтических вмешательств при Н/АОРБ расширяется за счет появления новых мишеней для лечения, включая биомолекулы. Развитие персонализированного подхода может рассматриваться как перспективное направления для повышения эффективности и безопасности лечения.
Литература
- Дорофеев В. и др. Великие лекарства. В борьбе за жизнь / Под ред. В. Дорофеева. М.: Альпина нон-фикшн, 2015. 226 с.
- Wilinski J., Lechowicz M., Kameczura T. et al. Non-steroidal anti-inflammatory drugs and paracetamol in self-therapy of various disorders in students of different fields of study // Folia Medica Cracoviensia. 2015. Vol. 55 (2). Р. 49–59.
- Johansson S. G., Hourihane J. O., Bousquet J. et al. A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force // J. Allergy. 2001. Vol. 56. Р. 813–824.
- Kowalski M. L., Asero R., Bavbek S. et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs // J. Allergy. 2013. Vol. 68. Р. 1219–1232.
- Widal M. F., Abrami P., Lermoyez J. Anaphylaxie et idiosyncrasie // La presse medicale. Paris. 1922. Vol. 30. Р. 189–192.
- Samter M., Beers R. F. Jr. Concerning the nature of intolerance to aspirin // Journal of Allergy. St. Louis. 1967. Vol. 40. Р. 281–293.
- Bochenek G., Bánska K., Szabó Z. et al. Diagnosis, prevention and treatment of aspirin-induced asthma and rhinitis // Curr Drug Targets Inflamm Allergy. 2002. Vol. 1. Р. 1–11.
- Krouse H. J., Krouse J. H. Samter’s Triad to Aspirin-Exacerbated Respiratory Disease: Historical Perspective and Current Clinical Practice // ORL Head Neck Nurs. 2015. Vol. 33. Р. 14–8.
- Williams A. N., Woessner K. M. The clinical effectiveness of aspirin desensitization in chronic rhinosinusitis // Current allergy and asthma reports. 2008. Vol. 8. Р. 245–252.
- Laidlaw T. M., Boyce J. A. Aspirin-Exacerbated Respiratory Disease — New Prime Suspects // N Engl J Med. 2016. Vol. 4. Р. 484–488.
- Глобальная стратегия лечения и профилактики бронхиальной астмы (пересмотр 2014 г.) / Пер. с англ. под ред. А. С. Белевского. М.: Российское респираторное общество, 2015. С. 71.
- Латышева Е. А. Аспирин-зависимые заболевания и возможности десенситизации: материалы Всероссийской конф. «Аллергология и иммунология: клинические рекомендации в пратику врача». М., 2016.
- Воржева И. И., Секретарева Л. Б., Черняк Б. А. Характеристика AERD-синдрома (aspirin-exacerbated respiratory disease) у больных бронхиальной астмой и полипозным риносинуситом в пожилом возрасте/Сб. трудов ХХII Национального Конгресса по болезням органов дыхания. М., 2012. С. 33–34.
- Kowalski M. L., Asero R., Bavbek S. et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs // Allergy. 2013. Vol. 68. Р. 1219–1232.
- Kowalski M. L., Makowska J. S., Blanca M. et al. Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) — classification, diagnosis and management: review of the EAACI/ENDA and GA2LEN/ HANNA // Allergy. 2011. Vol. 66. Р. 818–829.
- Lee R. U., Stevenson D. D. Aspirin-Exacerbated Respiratory Disease: Evaluation and Management // Allergy Asthma Immunol Res. 2011. Vol. 3. Р. 3–10.
- Chang J. E., White A., Simon R. A. et al. Aspirin-exacerbated respiratory disease: burden of disease // Allergy Asthma Proc. 2012. Vol. 33. Р. 117–121.
- Rajan J. P., Wineinger N. E., Stevenson D. D. et al. Prevalence of aspirin-exacerbated respiratory disease among asthmatic patients: A meta-analysis of the literature // J Allergy Clin Immunol. 2015. Vol. 135. Р. 676–681.
- Nabavi M., Esmaeilzadeh H., Arshi S. et al. Aspirin hypersensitivity in patients with chronic rhinosinusitis and nasal polyposis: frequency and contributing factors // Am J Rhinol Allergy. 2014. Vol. 28. Р. 239–243.
- Weber R. W., Hoffman M., Reine D. A. et al. Incidence of bronchoconstriction due to aspirin, azo dyes, non-azo dyes and preservatives in a population of perennial asthmatics // J Allergy Clin Immunol. 1979. Vol. 64. Р. 32–37.
- Israel E. Aspirin-induced asthma // UpToDate. 2000. Vol. 8. № 3.
- Ameratunga R., Randall N., Dalziel S. et al. Samter’s triad in childhood: a warning for those prescribing NSAIDs // Paediatr Anaesth. 2013. Vol. 23. Р. 757–759.
- Szczeklik A., Gryglewski R. J., Czerniawska-Mysik G. Relationship of inhibition of prostaglandin biosynthesis by analgesics to asthma attacks in aspirin-sensitive patients // BMJ. 1975. Vol. 1. Р. 67–69.
- Szczeklik A., Nizankowska-Mogilnicka E., Sanak M. Hypersensitivity to aspirin and nonsteroidal anti-inflammatory drugs. In: Adkinson N., Busse W. W., Bochner B. S., Holgate S. T., Simons E. R. & Lemanske R. F. editors. Middleton’s Allergy 7 th Edition. London: Mosby Elsevier, 2009: 1227–1243.
- Cahill K. N., Bensko J. C., Boyce J. A. et al. Prostaglandin D2: a dominant mediator of aspirin-exacerbated respiratory disease // J Allergy Clin Immunol. 2015. Vol. 135. Р. 245–252.
- Astafieva N. G. Platelet role in pathogenesis of atopic and nonimmunologic asthma // Allergol Immunopathol.1990. Vol. 18. Р. 19–26.
- Laidlaw T. M., Kidder M. S., Bhattacharyya N. et al. Cysteinyl leukotriene overproduction in aspirin-exacerbated respiratory disease is driven by platelet-adherent leukocytes // Blood. 2012. Vol. 119. Р. 3790–3798.
- Mitsui C., Kajiwara K., Hayashi H. et al. Platelet activation markers overexpressed specifically in patients with aspirin-exacerbated respiratory disease // J Allergy Clin Immunol. 2016. Vol. 137. Р. 400–411.
- Laidlaw T. M., Boyce J. A. Platelets in patients with aspirin-exacerbated respiratory disease // J Allergy Clin Immunol. 2015. Vol. 135. Р. 1407–1414.
- Евсюкова Е. В. Аспириновая астма. СПб: Нордмедиздат, 2010. С. 216.
- Bachert C., van Steen K., Zhang N. et al. Specific IgE against Staphylococcus aureus enterotoxins: an independent risk factor for asthma // J Allergy Clin Immunol. 2012; Vol. 130. Р. 376–381.
- Kim M. A., Izuhara K., Ohta S. et al. Association of serum periostin with aspirin-exacerbated respiratory disease // Ann Allergy Asthma Immunol. 2014. Vol. 113. Р. 314–320.
- Shin H. W., Kim D. K., Park M. H. et al. IL-25 as a novel therapeutic target in nasal polyps of patients with chronic rhinosinusitis // J Allergy Clin Immunol. 2015. Vol. 135. Р. 1476–1485.
- Lee S. H., Rhim T., Choi Y. S. et al. Complement C3 a and C4 a increased in plasma of patients with aspirin-induced asthma // Am J Respir Crit Care Med. 2006. Vol. 173. Р. 370–378.
- Akdis C. A., Hellings P. W., Agache I. Global Atlas of Allergic Rhinitis and Chronic Rhinosinusitis. Published by the European Academy of Allergy and Clinical Immunology, 2015, Р. 232–233.
- Ledford D. K., Wenzel S. E., Lockey R. F. Aspirin or other nonsteroidal inflammatory agent exacerbated asthma // J Allergy Clin Immunol Pract. 2014. Vol. 2. Р. 653–657
- Morales D. R., Guthrie B., Lipworth B. J. et al. NSAID-exacerbated respiratory disease: a meta-analysis evaluating prevalence, mean provocative dose of aspirin and increased asthma morbidity // Allergy. 2015. Vol. 70. Р. 828–835.
- Астафьева Н. Г. Роль тромбоцитов в развитии аллергических заболеваний. Дисс. д.м.н. Саратов, 1989. С. 439.
- Bochenek G., Kuschill-Dziurda J., Szafraniec K. et al. Certain subphenotypes of aspirin-exacerbated respiratory disease distinguished by latent class analysis // J Allergy Clin Immunol. 2014. Vol. 133. Р. 98–103.
- Skloot G. S. Asthma phenotypes and endotypes: a personalized approach to treatment // Curr Opin Pulm Med. 2016. Vol. 22. Р. 3–9.
- Szczeklik A., Picado C. Aspirin-induced asthma // Eur Respir Mon. 2003. Vol. 23. Р. 239–248.
- Jenkins C., Costello J., Hodge L. Systematic review of prevalence of aspirin induced asthma and its implications for clinical practice // BMJ. 2004. Vol. 328. Р. 434.
- Fahrenholz J. M. Natural history and clinical features of aspirin-exacerbated respiratory disease // Clin Rev Allergy Immunol. 2003. Vol. 24. Р. 113–124.
- Hedman J., Kaprio J., Poussa T. et al. Prevalence of asthma, aspirin intolerance, nasal polyposis and chronic obstructive pulmonary disease in a population-based study // Int J Epidemiol 1999. Vol. 28. Р. 717–722.
- Szczeklik A., Stevenson D. D. Aspirin-induced asthma: advances in pathogenesis, diagnosis, and management // J Allergy Clin Immunol. 2003. Vol. 111. Р. 913–921.
- Stevens W. W., Peters A. T., Suh L. et al. A retrospective, cross-sectional study reveals that women with CRSwNP have more severe disease than men // Immun Inflamm Dis. 2015. Vol. 3. Р. 14–22.
- Kowalski M. L., Bavbek S. Aspirin exacerbated respiratory disease. Global Atlas of Asthma/Ed. Akdis C. A., Agache I. EAACI, 2013. P. 92–94.
- Респираторная медицина: руководство в 2 т. /Под ред. А. Г. Чучалина. М.: ГЭОТАР-Медиа, 2007. Т. 1, 800 с. Т. 2, 816 с.
- Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы. URL: http://www.pulmonology.ru/publications/guide.php (дата обращения: 01.10.2015).
- Global Strategy for asthma management and prevention GINA. URL: http://www.toraks.org.tr/uploadFiles/2392014143556-GINA_Report_2014_Aug12.pdf.
- Global Strategy for asthma management and prevention GINA. URL: http://www.slideshare.net/cristobalbunuel/gina-report-2015.
- Fokkens W. J., Lund V. J., Mullol J. et al. European position paper on rhinosinusitis and nasal polyps 2012 // Rhinol Suppl. 2012. Vol. 23. Р. 1–298.
- Barranco P., Bobolea I., Larco J. I. et al. Diagnosis of aspirin-induced asthma combining the bronchial and the oral challenge tests: a pilot study // J Investig Allergol Clin Immunol. 2009. Vol. 19. Р. 446–452.
- Poznanovic S. A., Kingdom T. T. Total IgE levels and peripheral eosinophilia: correlation with mucosal disease based on computed tomographic imaging of the paranasal sinus // Arch Otolaryngol Head Neck Surg. 2007. Vol. 133. Р. 701–704.
- Fountain C. R., Mudd P. A., Ramakrishnan V. R. et al. Characterization and treatment of patients with chronic rhinosinusitis and nasal polyps // Ann Allergy Asthma Immunol. 2013. Vol. 111. Р. 337–341.
- Nizankowska-Mogilnicka E., Bochenek G., Mastalerz L. et al. EAACI/GA2 LEN guideline: aspirin provocation tests for diagnosis of aspirin hypersensitivity // Allergy. 2007. Vol. 62. Р. 1111–1118.
- Pierzchalska M., Mastalerz L., Sanak M. et al. A moderate and unspecific release of cysteinyl leukotrienes by aspirin from peripheral blood leucocytes precludes its value for aspirin sensitivity testing in asthma // Clin Exp Allergy. 2000. Vol. 30. Р. 1785–1791.
- Kowalski M. L., Ptasinska A., Jedrzejczak M. et al. Aspirin-triggered 15-HETE generation in peripheral blood leukocytes is a specific and sensitive Aspirin-Sensitive Patients Identification Test (ASPITest) // Allergy. 2005. Vol. 60. Р. 1139–1145.
- Gamboa P., Sanz M. L., Caballero M. R. et al. The flowcytometric determination of basophil activation induced by aspirin and other non-steroidal anti-inflammatory drugs (NSAIDs) is useful for in vitro diagnosis of the NSAID hypersensitivity syndrome // Clin Exp Allergy. 2004. Vol. 34. Р. 1448–1457.
- Sanz M. L., Gamboa P. M., Mayorga C. Basophil activation tests in the evaluation of immediate drug hypersensitivity // Curr Opin Allergy Clin Immunol. 2009. Vol. 9. Р. 298–304.
- Kim S. H., Choi H., Yoon M. G. et al. Dipeptidyl-peptidase 10 as a genetic biomarker for the aspirin-exacerbated respiratory disease phenotype // Ann Allergy Asthma Immunol. 2015. Vol. 114. Р. 208–213.
- Custovic A., Johnston S. L., Pavord I. et al. EAACI position statement on asthma exacerbations and severe asthma // Allergy. 2013. Vol. 68. Р. 1520–1531.
- Рязанцев С. В., Лопатин А. С., Пискунов Г. З., Карнеева О. В. Полипозный риносинусит: клинические рекомендации.. М.-СПб, 2014.
- Рязанцев С. В., Артюшкина В. К., Начаров П. В., Лаптиева М. А. Современные аспекты системной кортикостероидной терапии у больных хроническим полипозным риносинуситом // Российская оториноларингология. 2013. № 2. С. 114–121.
- Small C. B., Hernandes J., Reyes A. et al. Efficacy and safety of mometasone furoate nasal spray in nasal polyposis // J Allergy Clin. Immunol. 2005. Vol. 116. Р. 1275–1281.
- Varvyanskaya A. V., Lopatin A. S. Efficacy of long-term low-dose macrolide therapy in preventing early recurrence of nasal polyps after endoscopic sinus surgery // Int Forum Allergy Rhinol. 2014. Vol. 4. Р. 533–541.
- Stewart R. A., Ram B., Hamilton G. et al. Montelukast as an adjunct to oral and inhaled steroid therapy in chronic nasal polyposis // Otolaryngol. Head. Neck Surg. 2008. Vol. 139 (5). P. 682–687.
- Zhang H. P., Jia C. E., Lv Y. et al. Montelukast for prevention and treatment of asthma exacerbations in adults: Systematic review and meta-analysis // Allergy Asthma Proc. 2014. Vol. 35. P. 78–87.
- Virchow J. C., Mehta A., Ljungblad L. et al. Add-on montelukast in inadequately controlled asthma patients in a 6-month open-label study: the MONtelukast In Chronic Asthma (MONICA) study // Respir Med. 2010. Vol. 104. P. 644–651.
- Pauli C., Fintelmann R., Klemens C. et al. Polyposis nasi — improvement in quality of life by the influence of leukotrien receptor antagonists // Laryngorhinootologie. 2007. Vol. 86 (4). P. 282–286.
- Чучалин А. Г. Новые перспективы в терапии бронхиальной астмы // Пульмонология. 2011; (4): 5–12.
- Bachert C., Zhang L., Gevaert P. Current and future treatment options for adult chronic rhinosinusitis: Focus on nasal polyposis // J Allergy Clin Immunol. 2015. Vol. 136. P. 1431–1440.
- Gevaert P., Calus L., Van Zele T. et al. Omalizumab is effective in allergic and nonallergic patients with nasal polyps and asthma // J Allergy Clin Immunol. 2013. Vol. 131. P. 110–116.
- Aksu K., Kurt E. Aspirin tolerance following omalizumab therapy in a patient with aspirin-exacerbated respiratory disease // Allergol Immunopathol. 2013. Vol. 41. Р. 208–210.
- Hayashi H., Mitsui C., Nakatani E. et al. Omalizumab reduces cysteinyl leukotriene and 9 α,11 β-prostaglandin F2 overproduction in aspirin-exacerbated respiratory disease // J Allergy Clin Immunol. 2015. Nov 7.
- Gevaert P., Van Bruaene N., Cattaert T. et al. Mepolizumab, a humanized anti-IL-5 mAb, as a treatment option for severe nasal polyposis // J Allergy Clin Immunol. 2011. Vol. 128. Р. 989–995.
- Stevenson D. D., White A. A. Aspirin Desensitization in Aspirin-Exacerbated Respiratory Disease: Consideration of a New Oral Challenge Protocol // J Allergy Clin Immunol Pract. 2015. Vol. 3. Р. 932–933.
- White A. A., Stevenson D. D. Aspirin-exacerbated respiratory disease: update on pathogenesis and desensitization // Semin Respir Crit Care Med. 2012. Vol. 33. Р. 588–594.
- Астафьева Н. Г., Кобзев Д. Ю. Между верой и знанием: официальная, альтернативная и комплементарная медицина в лечении астмы и аллергии (ч. 1, ч. 2) // Лечащий Врач, 2012, № 6, с. 59–62; № 8, с. 74–77.
- Астафьева Н. Г. Аспириновая бронхиальная астма: диагностика, лечение и профилактика. В кн.: Клинические рекомендации. Бронхиальная астма / Под ред. А. Г. Чучалина. М.: Издат. дом «Атмосфера», 2008. С. 141–116.
- Sommer D. D., Hoffbauer S., Au M. et al. Treatment of aspirin exacerbated respiratory disease with a low salicylate diet: a pilot crossover study // Otolaryngol Head Neck Surg. 2015. Vol. 152. Р. 42–47.
- Ta V., White A. A. Survey-Defined Patient Experiences With Aspirin-Exacerbated Respiratory Disease // J Allergy Clin Immunol Pract. 2015. Vol. 3. Р. 711–718.
- Cardet J. C., White A. A., Barrett N. A. et al. Alcohol-induced respiratory symptoms are common in patients with aspirin exacerbated respiratory disease // J Allergy Clin Immunol Pract. 2014. Vol. 2. Р. 208–213.
Н. Г. Астафьева1, доктор медицинских наук, профессор
И. В. Гамова, кандидат медицинских наук
Д. Ю. Кобзев, доктор медицинских наук, профессор
Е. Н. Удовиченко, кандидат медицинских наук
И. А. Перфилова, кандидат медицинских наук
И. Э. Михайлова
ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
1 Контактная информация: astang@mail.ru
Купить номер с этой статьей в pdf