На сегодняшний день отмечается возрастание частоты повреждений органов опорно-двигательного аппарата и тканей. Этому способствуют природные и антропогенные катастрофы, бурное развитие всех видов транспорта, что обусловливает высокий травматизм в мирное время. Во время вооруженных конфликтов, террористических актов процент травматизма возрастает в разы. Данные обстоятельства требуют от врачей надежных средств, методов и результатов лечения.
На протяжении многих лет механические свойства костной ткани, а также механизмы, лежащие в основе их изменений при различных заболеваниях, представляют значительный научный и медицинский интерес. Знание этих механизмов позволяет детальнее углубиться в процессы патогенеза заболеваний опорно-двигательной системы человека, что открывает новые перспективы не только в вопросах профилактики и лечения таких патологий, как остеоартроз крупных и мелких суставов, асептический некроз костей, но и в реабилитации после переломов [1].
Центральным механизмом репарации костной ткани является формирование костного матрикса, структурной основой которого являются коллагеновые волокна. Костный матрикс, который является основой для усвоения кальция скелетом, на 90% состоит из коллагена 1-го типа. В активную фазу репарации кости отмечается повышение синтеза коллагена 3-го типа. Поскольку синтез коллагена любого типа зависит от обеспеченности организма рядом остеогенных микронутриентов, то и время репаративного остеогистогенеза после перелома, и качество срастания кости существенно зависят не только от кальция и витамина D, но также от остеогенных микронутриентов: цинка, марганца, бора, меди, магния. Однако, несмотря на многочисленные публикации с патофизиологическим обоснованием роли указанных микронутриентов в метаболизме костной ткани, до настоящего времени отсутствовали как экспериментальные, так и клинические данные, подтверждающие их влияние в составе лекарственных средств на коллаген и другие компоненты органического матрикса кости, особенно в ходе регенерации после переломов. Настоящее исследование является попыткой в какой-то мере восполнить этот пробел. В качестве изучаемого препарата было избрано доступное на отечественном рынке лекарственное средство Кальцемин Адванс, предназначенное для повышения обеспеченности организма остеогенными микронутриентами.
Материалы и методы исследования
Целью нашего исследования являлось изучение влияние препарата Кальцемин Адванс на регенерацию, биомеханические свойства и содержание коллагена в костной ткани после перелома берцовой кости. До начала эксперимента было получено разрешение этического комитета ГБОУ ВПО ИвГМА на проведение данного исследования от 6.09.2014 г.
Для достижения поставленной цели решались следующие задачи: 1) формирование контрольных и опытных групп объектов исследования (капюшонные крысы) по принципу однородности; 2) проведение операции; 3) зондирование крыс Кальцемином Адванс (опытная группа) и водой (контрольная группа); 4) отслеживание динамики регенерации, включая оценку биомеханических свойств кости; 5) оценка уровней коллагенов 1-го и 3-го типа в кости; 6) оценка гистологической картины костной ткани в месте перелома (костной мозоли).
Отбор крыс осуществлялся по следующим критериям: в исследование были включены здоровые животные (блестящие глаза; кожные покровы чистые, без видимых повреждений, густой, блестящий мех), активные, с хорошим аппетитом, возраст около 1 года, весом от 280 до 350 грамм. При вхождении в эксперимент проводилось взвешивание животных на электронных весах. Данные о каждом животном заносились в таблицу с указанием номера, веса, особенностей окраски и других показателей. Каждая крыса маркировалась пикриновой кислотой по мере вхождения в эксперимент, после чего было произведено отсаживание экспериментальных крыс в отдельные клетки.
Непосредственно перед операцией проводили контрольное взвешивание и оценку физического состояния животных. В качестве обезболивающего средства использовали хлоралгидрат (350 мг/кг внутрибрюшинно). После ввода в наркоз животное фиксировалось в станке, в области бедра правой задней конечности удалялся волосяной покров, на бедре рассекались ткани, обнажалась малоберцовая кость, после чего производился контролируемый перелом кости. Затем края раны стягивались и зашивались непрерывным швом, на лапу животного накладывалась шина. Затем каждая крыса помещалась в отдельную клетку; всем животным обеспечивались одинаковые условия (доступ к воде, стандартный рацион вивария, одинаковая освещенность и режим проветривания).
Зондирование препаратом и контроль регенерации проводились 5 раз в неделю в течение 30 дней. С первого дня после операции проводились измерения площади перелома в контрольной и опытной группах, затем проводилось зондирование препаратом или водой. Контрольная группа (n = 30) получала воду (3 мл), опытная группа (n = 30) — препарат Кальцемин Адванс из расчета 0,1 мл взвеси на килограмм массы тела. Для сравнений также использовались данные о состоянии костной ткани животных в интактном контроле (без перелома, n = 10).
Навески препарата приготавливались на электронных весах. На 31-й день животных всех групп выводили из эксперимента. Спустя сутки после последнего приема Кальцемина Адванс крыс декапитировали (под наркозом с использованием хлоралгидрата в дозе 700 мг/кг внутрибрюшинно). Затем иссекали область перелома и проводили окрашивание костной ткани в месте перелома специальными методиками с последующим приготовлением микросрезов кости в месте перелома для гистологической оценки и изучали уровни коллагена в костной ткани в месте перелома в группе 1 и 2.
Определение коллагена в образцах костной ткани
Определение коллагена (общего, 1-го или 3-го типов) в тканях обычно проводится путем растворения коллагена посредством пептидаз (QuickZyme, Chondrex и др. методики). Однако данный метод неприменим для определения коллагена в кости, т. к. пептидазы растворяют не более 10–12% коллагена в кости. Поэтому для оценки коллагенового метаболизма при оценке заживления кости после перелома целесообразно использовать иммуногистохимический анализ.
Для иммуногистохимической оценки экспрессии коллагенов 1-го и 3-го типа депарафинизированные срезы кости промывали натрий-фосфатным буфером, инкубировали с 0,3% перекисью водорода в течение 20 мин, чтобы блокировать активность эндогенной пероксидазы с последующей инкубацией с 5% бычьего сывороточного альбумина. Затем срезы инкубировали с оптимальными концентрациями первичных антител для COL-I (1:100; Sigma Aldrich, Сент-Луис, США) в течение ночи при 4 °С. После три раза промывали натрий-фосфатным буфером, срезы инкубировали с биотинилированными вторичными антителами в течение 20 мин перед инкубацией с конъюгированным с пероксидазой хрена авидинбиотиновым комплексом в течение еще 20 мин. Иммуноокрашивание визуализировали после добавления 3,3-диаминобензидин тетрагидрохлорида. Затем срезы прокрашивали гематоксилином Харриса в течение 40 сек, в пределах от 3 мин полосканий с проточной водой. Срезы обезвоживали растворами этанола повышающихся концентраций и очищали в ксилоле. Образцы были исследованы под световым микроскопом Olympus (Япония). Для подтверждения результатов каждый эксперимент был повторен по крайней мере три раза. Регенерация кости на этих гистологических срезах оценивалась по полуколичественной балльной шкале с помощью модифицированного метода подсчета баллов [2]. Число остеокластов подсчитывали под световым микроскопом.
Результаты и обсуждение
Исследование показало, что включение препарата в стандартную терапию перелома берцовой кости приводит к улучшению биомеханических свойств кости, увеличению скорости и качества формирования костной мозоли. Кроме того, методами иммуногистохимии было установлено повышение синтеза коллагенов 1-го и 3-го типа в зоне срастания перелома. В соответствии с рандомизированным дизайном исследования, все эти эффекты следует относить именно к приему препарата Кальцемин Адванс.
Для оценки влияния Кальцемина Адванс на биомеханические свойства кости измерялись такие параметры, как удельная стрела прогиба, предел прочности, модуль упругости, и вычислялась т. н. «работа разрушения» кости. На 30-й день значения удельной стрелы прогиба составили 3,20 ± 0,12 НмкМ (Кальцемин Адванс) и 2,86 ± 0,10 НмкМ в контрольной группе (р < 0,03, рис. 1а).
Значения других показателей биомеханической прочности кости также были повышены у животных в опытной группе. Прием препарата повышал предел прочности (опыт — 218 ± 8 гПа, контроль — 198 ± 6 гПа, p < 0,05, рис. 1б), модуль упругости (опыт — 6,12 ± 0,25 гПа, контроль — 5,12 ± 0,44, p < 0,01, рис. 1в), работу разрушения (опыт — 182 ± 12 мДж, контроль — 141 ± 8 мДж, p < 0,05, рис. 1г). Такие изменения биомеханических параметров следует интерпретировать как снижение хрупкости кости на фоне увеличения прочности и эластичности.
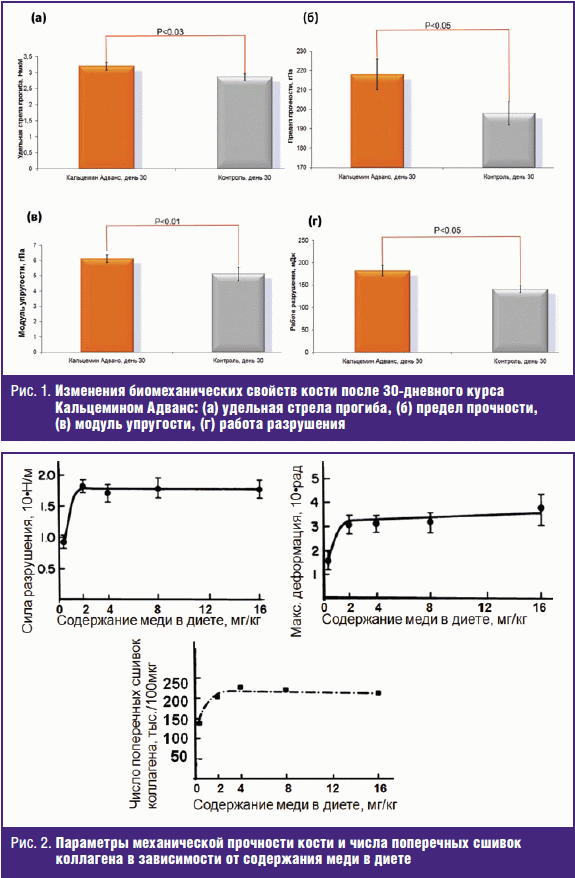
Заметим, что в работе, проведенной ранее в Луганском медицинском университете на самках белых крыс пожилого возраста (18–24 мес), были установлены сравнимые значения приращения показателей при приеме Кальцемина по сравнению с контролем. Так, среднее увеличение удельной стрелы прогиба составило + 0,39 НмкМ, предела прочности — + 11 гПа, модуля упругости — + 0,45 гПа, работы разрушения — + 14 мДж [3].
Таким образом, прием препарата Кальцемин Адванс достоверно (по сравнению с контролем) стимулирует повышение прочностных характеристик кости. На наш взгляд, это связано с поступлением в организм не только кальция и витамина D
Медь участвует в модификации определенных лизиновых остатков коллагена и эластина, что имеет важное значение для формирования коллагеновых и эластиновых фибрилл. Одним из факторов, способствующих потере костной массы, являются субклинические дефициты цинка и меди, возникающие вследствие уменьшенного потребления или нарушений всасывания этих микроэлементов в организме. Недостаток меди у человека и у животных связан с нарушениями роста, остеогенеза и хрупкостью костей, что во многом обусловлено недостаточным количеством этих поперечных сшивок. В эксперименте дефицит меди приводил к нарушению структуры коллагена и снижению таких механических свойств кости, как максимальный устойчивый крутящий момент, конечная угловая деформация и прочность (р < 0,05) [4, 5].
Дефицит меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечно-сосудистой системы. Медь, являясь кофактором фермента лизилоксидазы (ген LOX), имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене. Трехмерная сеть соединительной ткани поперечно-полосатых мышц состоит, в основном, из нитей коллагена.
У животных на медь-дефицитной диете структура этой сети нарушается именно вследствие снижения активности лизилоксидазы [6, 7]. Снижение активности при низком содержании меди в диете приводит к снижению числа поперечных сшивок нитей коллагена и к ухудшению показателей механической прочности кости (рис. 2).
Установленное в настоящем исследовании улучшение гибкостных характеристик кости (удельная стрела прогиба, модуль упругости) при приеме Кальцемина Адванс связано не только с наличием меди в составе данного препарата, но и с наличием марганца. Марганец — эссенциальный микроэлемент и кофактор более 200 белков. К клиническим симптомам марганцевого дефицита относятся повышенная хрупкость костей, нарушения образования хрящевой ткани, аномалии развития скелета, задержка роста волос и ногтей. Эффекты долгосрочного дефицита марганца и меди в диете включают снижение минерализации в сочетании с увеличением резорбции кости [8, 21].
Хронический дефицит марганца и меди приводит к снижению активности строящих кость остеобластов, увеличению резорбции костного матрикса и, следовательно, снижению плотности и массы костей. В эксперименте недостаточность меди и марганца приводила к значительному снижению содержания кальция в кости (180 мг/г, дефицит Mn/Cu и 272 мг/г, контроль), причем содержание кальция в кости было обратно пропорционально концентрации кальция в сыворотке (r = –0,69, p < 0,01).
Рентгенограммы плечевых костей указали на присутствие многочисленных очагов повреждения кости как при сочетанном дефиците Mn/Cu, так и при глубоком дефиците марганца [8, 21].
Эффекты марганца на соединительную ткань обусловлены воздействием дефицита марганца на структуру т. н. «гелеобразной среды», этого важнейшего компонента соединительной ткани. Гелеобразная среда образована протеогликанами — чрезвычайно растянутыми полипептидными цепями с многочисленными полисахаридными цепями глюкозаминогликанов, присоединенных посредством ковалетных связей. Многочисленные цепи протеогликанов прикрепляются к особому виду глюкозаминогликана — полимеру гиалуроновой кислоты, называемому гиалуронаном. Нити гиалуронана скрепляют структуру геля в единое целое, и этот полисахаридный «гель» может противостоять сжатию и растяжению внутриклеточного матрикса и в то же время обеспечивает быструю диффузию питательных веществ, строительных материалов и гормонов между кровью и клетками соединительной ткани. Механически структура геля усилена посредством коллагеновых и эластиновых волокон.
Установлено по меньшей мере три разновидности марганец-зависимых ферментов, которые принимают участие в синтезе глюкозаминогликанов и других углеводных компонентов протеогликанов. К этим ферментам относятся галактозилксилозил глюкуронозилтрансферазы, бета-галактозилтрансферазы и N-ацетилгалактозаминил-трансферазы. Галактозилксилозил глюкуронозилтрансферазы (гены B3GAT1, 2, 3) играют важную роль в биосинтезе таких гликозаминогликанов, как хондроитин сульфат, дерматан сульфат, гепаран сульфат и гепарин. Бета-галактозилтрансферазы (гены B4GALT1, 2, 3, 4, 5, 6, 7) участвуют в биохимических модификациях и присоединении глюкозаминогликанов, и активность этих ферментов оказывает значительное влияние на структуру внеклеточной матрицы СТ.
N-ацетилгалактозаминилтрансферазы (гены GALNT1, 2, …, 15) необходимы для синтеза глюкозаминогликана хондроитин сульфата. Хондроитин сульфат состоит из повторяющих дисахардных последовательностей N-ацетилгалактозаминовых и глюкоуроновых остатков, и данный фермент присоединяет N-ацетилгалактозамины к растущей полисахаридной цепи. Марганец-зависимые N-ацетилгалактоз-аминилтрансферазы необходимы для нормальной оссификации [9] и нормального развития хряща. Дефицит марганца приводит к разрушению конформации активного центра и резкому падению активности фермента [10].
Помимо воздействия на биомеханические свойства кости, прием препарата Кальцемин Адванс приводил к существенному сокращению сроков полной консолидации берцовой кости. У крыс контрольной группы в ходе наблюдения полная консолидация перелома берцовой кости достигалась на 12–13 день эксперимента (12,5 ± 2,1 дня). При приеме препарата консолидация перелома берцовой кости происходила на 7–8 день эксперимента (7,4 ± 2,2 дня), т. е. в 1,6 раза быстрее, чем в группе контроля (р = 0,006).
По завершении эксперимента также проводилось гистологическое исследование качества ткани в костной мозоли у всех подопытных животных. Результаты иммуногистохимического анализа образцов кости в области перелома указали на повышенное накопление коллагенов 1-го и 3-го типа в области шва в основной группе, что коррелирует с ускорением срастания кости и улучшением качества костной мозоли. Интенсивность иммуногистохимического окрашивания образцов тканей на коллаген в контрольной группе была достаточно невысока, ткань характеризовалась разреженной структурой. По сравнению с данными для интактного контроля (без перелома), принятыми за 100%, интенсивность окрашивания на коллаген 1-го типа составила 67 ± 16% в контрольной группе. В то же время интенсивность окрашивания на коллаген 1-го типа составила 89 ± 12% при приеме Кальцемина Адванс (р = 0,05). Таким образом, Кальцемин Адванс содержит остеотропные минералы: цинк, медь, магний, марганец и бор, которые способствуют синтезу коллагенов 1-го и 3-го типа.
Помимо меди и марганца, которые необходимы для синтеза костного матрикса и коллагенов, имеют важное значение цинк и бор. Цинк и бор — принципиально важные кофакторы ферментов, участвующих в синтезе различных молекулярных компонентов матрикса костной ткани [11]. Цинк необходим для поддержания и дифференцировки остеобластов и синтеза коллагена. Также он регулирует уровень инсулиноподобного фактора роста (ИФР-1). Дефицит цинка приводит к нарушению синтеза ДНК и метаболизма белка, что ведет к нарушению синтеза органического матрикса [12].
Бор, который также входит в состав препарата Кальцемин Адванс, оказывает существенное воздействие на процессы роста клеток костной ткани. Так, бор повышает одонтогенную и остеогенную дифференцировку клеток ростка стволовых клеток дентина [13]. Бор дозозависимо влияет на процессы дифференцировки стромальных клеток костного мозга. Концентрации бора в 1, 10 и 100 нг/мл повышали, а уровни более 1000 нг/мл ингибировали дифференцировку клеток (р < 0,05). При уровнях бора в 10…100 в питательной среде культуры клеток костного мозга также повышались уровни белков остеогенеза — остеокальцина, коллагена 1-го типа, белков морфогенеза костей 4, 6 и 7 (р < 0,05) [14], а также остеопонтина и сиалопротеина кости [15]. Таким образом, накопленные данные свидетельствуют о значительном влиянии бора на синтез коллагена и формирование костного матрикса.
Бор воздействует на процессы депонирования кальция в костной ткани. Прием экспериментальной диеты, содержащей бор в количестве 3 мг/кг, в течение 20 дней приводил к повышению площади минерализации кости, общей площади кости и числа остеобластов [16]. Гистоморфометрическое исследование эффектов глубокого пищевого дефицита бора (норма — 3 мг B/кг пищи, экспериментальная В-дефицитная диета — 0,07 мг B/кг) указало на нарушения структуры альвеолярной кости пародонта [17]. В норме зрелые кубические остеобласты выстилали 52 ± 9% поверхности кости, при дефиците бора — только 19 ± 10%.
Сравнительный экспериментальный анализ группы животных, принимавших только 300 мг/сут кальция, по сравнению с группой, принимавшей кальций в сочетании с 2 мг/сут бора, показал, что добавление бора способствовало достижению наивысшей механической прочности костной ткани [18].
Определенный уровень физической активности может быть необходим для осуществления позитивных эффектов бора на костную ткань. В эксперименте прием 50 мг/кг бора в форме тетрабората натрия (Na2B4O7) на фоне интенсивного курса тренировки на беговой дорожке приводил к достоверному увеличению позвоночной и бедренной костной массы. Длина бедра, степень минерализации и плотность кости, объем трабекулярной кости и толщина губчатой были значительно выше при приеме бора (р < 0,005) [19]. Прием препаратов бора в группе спортсменок приводил к увеличению минеральной плотности костной ткани, в то время как в группе участниц, ведущих малоподвижный образ жизни, наоборот, отмечено снижение МПК [20].
Заключение
Возможности полного восполнения дефицитов микроэлементов, необходимых для функционирования костной ткани (прежде всего, для синтеза коллагена и, следовательно, костного матрикса) существенно расширяются при использовании специальных микронутриентных препаратов, например препарата Кальцемин Адванс. Магний, марганец, медь, цинк и бор принято называть остеогенными элементами. В настоящей работе экспериментально показано, что сочетанный прием кальция с этими остеогенными элементами и витамином D способствует улучшению и ускорению темпов сращивания берцовой кости после перелома. Остеогенные элементы способствуют синтезу коллагенов 1-го и 3-го типа и, как следствие, синтезу полноценного костного матрикса.
Литература
- Кукин И. А., Кирпичёв И. В., Маслов Л. Б., Вихрев С. В. Особенности прочностных характеристик губчатой кости при заболеваниях тазобедренного сустава // Росс. мед. журнал. 2013, № 7, 328–333.
- Mankani M. H., Kuznetsov S. A., Avila N. A., Kingman A., Robey P. G. Bone formation in transplants of human bone marrow stromal cells and hydroxyapatitetricalcium phosphate: prediction with quantitative CT in mice // Radiology. 2004; 230: 369 e76.
- Лузин В. И., Склянина Л. В., Афонин Д. Н., Нехорошев М. В. Биомеханические характеристики скелета самок белых крыс старческого возраста при применении препарата Кальцемин // У.М.Ж. 2003, 6 (2): 100–103.
- Jonas J., Burns J., Abel E. W., Cresswell M. J., Strain J. J., Paterson C. R. Impaired mechanical strength of bone in experimental copper deficiency // Ann Nutr Metab. 1993; 37 (5): 245–252.
- Opsahl W., Zeronian H., Ellison M., Lewis D., Rucker R. B., Riggins R. S. Role of copper in collagen cross-linking and its influence on selected mechanical properties of chick bone and tendon // J Nutr. 1982; 112 (4): 708–716.
- Kaitila I. I., Peltonen L., Kuivaniemi H., Palotie A., Elo J., Kivirikko K. I. A skeletal and connective tissue disorder associated with lysyl oxidase deficiency and abnormal copper metabolism // Prog Clin Biol Res. 1982; 104: 307–315.
- Borg T. K., Klevay L. M., Gay R. E., Siegel R., Bergin M. E. Alteration of the connective tissue network of striated muscle in copper deficient rats // J Mol Cell Cardiol. 1985; 17 (12): 1173–1183.
- Strause L. G., Hegenauer J., Saltman P., Cone R., Resnick D. Effects of long-term dietary manganese and copper deficiency on rat skeleton // J Nutr. 1986; 116 (1): 135–141.
- Sato T., Kudo T., Ikehara Y., Ogawa H., Hirano T., Kiyohara K., Hagiwara K., Togayachi A., Ema M., Takahashi S., Kimata K., Watanabe H., Narimatsu H. Chondroitin sulfate N-acetylgalactosaminyltransferase 1 is necessary for normal endochondral ossification and aggrecan metabolism // J Biol Chem. 2011; 286 (7): 5803–12 doi.
- Watanabe Y., Takeuchi K., Higa Onaga S., Sato M., Tsujita M., Abe M., Natsume R., Li M., Furuichi T., Saeki M., Izumikawa T., Hasegawa A., Yokoyama M., Ikegawa S., Sakimura K., Amizuka N., Kitagawa H., Igarashi M. Chondroitin sulfate N-acetylgalactosaminyltransferase-1 is required for normal cartilage development // Biochem J. 2010; 432 (1): 47–55 doi.
- Kaitila I. I., Peltonen L., Kuivaniemi H., Palotie A., Elo J., Kivirikko K. I. A skeletal and connective tissue disorder associated with lysyl oxidase deficiency and abnormal copper metabolism // Prog Clin Biol Res. 1982; 104: 307–315.
- Naghii M. R., Torkaman G., Mofid M. Effects of boron and calcium supplementation on mechanical properties of bone in rats // Biofactors. 2006; 28 (3–4): 195–201.
- Tasli P. N., Dogan A., Demirci S., Sahin F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro // Biol Trace Elem Res. 2013; 153 (1–3): 419–427 doi.
- Ying X., Cheng S., Wang W., Lin Z., Chen Q., Zhang W., Kou D., Shen Y., Cheng X., Rompis F. A., Peng L., Zhu Lu C. Effect of boron on osteogenic differentiation of human bone marrow stromal cells // Biol Trace Elem Res. 2011; 144 (1–3): 306–315 doi.
- Hakki S. S., Bozkurt B. S., Hakki E. E. Boron regulates mineralized tissue-associated proteins in osteoblasts (MC3 T3-E1) // J Trace Elem Med Biol. 2010; 24 (4): 243–250 doi.
- Uysal T., Ustdal A., Sonmez M. F., Ozturk F. Stimulation of bone formation by dietary boron in an orthopedically expanded suture in rabbits // Angle Orthod. 2009; 79 (5): 984–490 doi.
- Gorustovich A. A., Steimetz T., Nielsen F. H., Guglielmotti M. B. A histomorphometric study of alveolar bone modelling and remodelling in mice fed a boron-deficient diet // Arch Oral Biol. 2008; 53 (7): 677–682 doi.
- Naghii M. R., Torkaman G., Mofid M. Effects of boron and calcium supplementation on mechanical properties of bone in rats // Biofactors. 2006; 28 (3–4): 195–201.
- Rico H., Crespo E., Hernandez E. R., Seco C., Crespo R. Influence of boron supplementation on vertebral and femoral bone mass in rats on strenuous treadmill exercise. A morphometric, densitometric, and histomorphometric study // J Clin Densitom. 2002; 5 (2): 187–192.
- Meacham S. L., Taper L. J., Volpe S. L. Effects of boron supplementation on bone mineral density and dietary, blood, and urinary calcium, phosphorus, magnesium, and boron in female athletes // Environ Health Perspect. 1994; 102 Suppl: 79–82.
- Parlier R., Hioco D, Leblanc R. Metabolism of magnesium and its relation to that of calcium. I. Apropos of a study of magnesium balance in the normal man, in osteopathies and nephropathies // Rev Fr Endocrinol Clin. 1963; 4: 93–135.
Н. Ю. Жидоморов*, кандидат медицинских наук
О. А. Громова*, 1, доктор медицинских наук, профессор
И. Ю. Торшин**, кандидат химических наук
А. Ю. Волков**
В. Н. Носиков***, кандидат химических наук
* ГБОУ ВПО ИвГМА МЗ РФ, Иваново
** РСЦ Института микроэлементов ЮНЕСКО при РНИМУ им. Н. И. Пирогова, Москва
*** ВНИИ агрохимии им. Д. Н. Прянишникова РАСН, Москва
1 Контактная информация: unesco.gromova@gmail.com
Купить номер с этой статьей в pdf