Какова терапевтическая активность антилейкотриеновых препаратов?
Возможно ли их сочетание с другими группами противоастматических препаратов?
Известно, что при лечении бронхиальной астмы (БА) кромоны слабо эффективны, а ингаляционные и системные глюкокортикоиды (Гк) имеют немало побочных явлений. Кроме того, показано отсутствие достоверного влияния Гк на синтез таких медиаторов аллергии, как лейкотриены (Лт) у астматиков и здоровых лиц [5, 6, 9]. В свою очередь, противовоспалительный эффект модификаторов Лт усиливается при применении их с Гк [3, 4, 8].
Место антилейкотриеновых препаратов в терапии БА еще до конца не определено. Считается, что они могут успешно заменить противовоспалительную терапию малыми дозами ингаляционных Гк (иГк) при персистирующей БА (заключение экспертов США); их назначение даже более оправданно при тяжелой форме заболевания (Японское руководство по БА).
В обзорной статье мы приведем некоторые результаты оценки терапевтической эффективности ингибиторов рецепторов Лт аколата и сингуляра у детей с БА [1–4].
При обследовании 80 детей с легкой/средней степенью тяжести БА в возрасте 6–14 лет, имеющих респираторные проявления на физическую нагрузку (кашель, свистящее дыхание), у 9% из них на 5–10 мин после окончания бега на тредмиле зафиксирован постнагрузочный бронхоспазм: снижение объема форсированного выдоха за 1 с (ОФВ1) более чем на 15% (среднее значение максимального падения ОФВ1 составило 32%) [1]. Таким больным дополнительно назначался сингуляр в дозе 5 мг однократно на ночь. Через 2 дня, а также 1 и 2 месяца после его приема у больных наблюдалось улучшение переносимости физической нагрузки (см. рисунок).
Аколат — высокоселективный антагонист цистеиновых лейкотриеновых рецепторов — способен тормозить ранний и поздний аллергический ответ, ингибировать бронхоспазм, вызываемый физической нагрузкой, провокацией холодным воздухом, ацетилсалициловой кислотой [5, 7, 9, 11]. При назначении препарата в сочетании с β2-агонистом отмечались значительное улучшение клинической симптоматики легкой/средней степени тяжести БА у детей старше 12 лет, повышение ОФВ1 на 11%, улучшение контроля астмы у больных, получавших высокие дозы иГк [2, 4, 5, 7, 11].
Могут ли модификаторы Лт быть полезными при лечении БА средней степени тяжести, то есть в тех случаях, когда обоснованным считается назначение иГк (Национальная программа, GINA)?
Целью нашего исследования была оценка терапевтической эффективности аколата у детей со средней формой БА, принимавших и не принимавших иГк [2].
Вошедшие в открытое рандомизированное исследование пациенты были разделены на две параллельные группы:
- Больные, ранее не принимавшие иГк (n=8), с исходным ОФВ1 69–79% должного, у которых наблюдалось плохо контролируемое течение БА на фоне приема кропоза, теопэка, вентолина. К концу вводного периода (3-4 недели) у детей сохранялись суточное колебание пикфлоуметрии более 15% и потребность в приеме вентолина чаще двух раз в неделю.
- Пациенты (n=9), у которых заканчивался курс лечения иГк в связи с достижением контроля над симптомами болезни. Эти дети имели стабильное течение средней формы БА, ОФВ1>80%, суточное колебание пикфлоуметрии менее 10%. Они получали 200–400 мкг бекотида или фликсотида 3–4 месяца на фоне кромонов.
Всем больным назначался аколат — 40 мг в сутки в течение 3 месяцев, вентолин по потребности. У больных второй группы через 2 недели после приема аколата дозу иГк снижали вдвое, а затем полностью отменяли. Двое детей из первой группы в течение 3 недель продолжали принимать теопэк, остальные — интал плюс 2–3 раза в сутки. У больных проводили исследование функции легких с помощью компьютерной флоуметрии по программе СПИРОТЕСТ. Показатели кривой поток-объем включали ОФВ1 и объемные скорости выдоха — МОС 25%, 50%, 75%. Статистическую обработку полученных данных проводили по t-критерию Стьюдента.
Полученные результаты показали, что в процессе приема аколата у больных первой группы, не получавших иГк, прирост ОФВ1 составил 6% через месяц и достиг статистически достоверных различий к концу 2-3-го месяца (р<0,05) (табл. 1). У больных второй группы, у которых на фоне приема аколата отменили терапию иГк, среднее значение ОФВ1 практически не менялось в течение всего срока наблюдения. Показатели МОС 50% и МОС 75% значительно улучшились в обеих группах больных по сравнению с исходным значением (р<0,05), МОС 25% — статистически недостоверно (табл. 1).
Изменился также характер дневных/ночных симптомов БА. Так, у пациентов первой группы, у которых в течение вводного периода регистрировалась большая частота симптомов по сравнению с больными второй группы, к концу наблюдения в дневниках самоконтроля было отмечено трехкратное уменьшение потребности в вентолине (27 ингаляций в месяц в начале лечения и 7 ингаляций через 3 месяца после приема аколата). Через 2–3 месяца после окончания лечения аколатом у двух больных из первой группы и пятерых из второй наблюдалось обострение болезни, в связи с чем им были назначены иГк или повторный курс аколата.
Полученные данные позволяют предположить, что эффект от приема аколата у больных первой группы, имевших плохо контролируемое течение БА, сопоставим с действием низких/средних доз иГк. Этот вывод подтверждается результатами наблюдения за пациентами второй группы, принимавшими иГк не менее 3 месяцев; этого срока достаточно для воздействия на бронхиальную гиперреактивность (Ind P., 1996; Pederson S., 1997). Их состояние оставалось стабильным и после отмены иГк на фоне приема аколата [2].
Следует предположить, что комбинация антилейкотриеновых и глюкокортикоидных препаратов позволяет достичь аддитивного и взаимоусиливающего эффекта, особенно у больных с тяжелой формой БА.
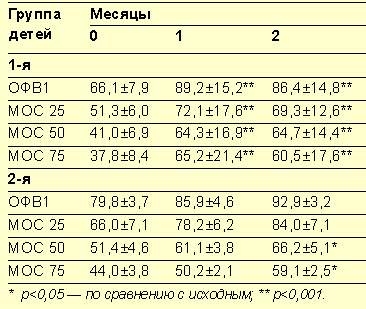
При изучении эффективности комбинации аколата и пульмикорта турбухалера у детей со средней/тяжелой БА, ранее принимавших иГк, мы оценивали клиническое состояние больных, включая симптомы БА, потребность в β2-агонистах и динамику показателей функции внешнего дыхания в начале исследования и через 1 и 2 месяца после приема аколата (табл. 2) [4].
Исследованием были охвачены 15 больных, 8 из которых принимали иГк. Пациенты первой группы имели более низкое исходное значение ОФВ1 (66% должного) по сравнению с детьми, составлявшими вторую группу (средний уровень ОФВ1 79,8%) (статистическое отличие между группами недостоверно, р<0,01). Анамнестические данные больных первой группы, а также назначение им иГк еще до включения этих пациентов в исследование свидетельствуют о среднетяжелом течении заболевания. Несмотря на персистирующий характер БА, больным второй группы в качестве альтернативы иГк назначался антилейкотриеновый препарат аколат.
Полученные результаты свидетельствуют о том, что сочетанное применение аколата и пульмикорта турбухалера более благоприятно влияет на функцию легких. Так, у больных первой группы при более низком базальном уровне ОФВ1 выраженный прирост всех показателей кривой поток-объем был достигнут к концу первого месяца терапии и сохранялся на протяжении всего периода наблюдения (р<0,001, р<0,05). У больных второй группы лечение аколатом также способствовало повышению функциональных показателей легких с достоверным улучшением МОС 50% и МОС 75% после 2 месяцев приема препарата (табл. 3).
Таблица 3. Динамика параметров кривой поток-объем в процессе терапии детей с бронхиальной астмой,% |
Максимальный прирост ОФВ1 к концу второго месяца наблюдения составил 20% в группе больных, принимавших пульмикорт турбухалер в сочетании с аколатом (ОФВ1 — 86%), и 13% — у больных, не использующих в лечении иГк (вторая группа). В обеих группах отмечено значительное снижение количества ингаляций вентолина к концу лечения (суточная потребность в β2-агонисте снизилась в 5–6 раз по сравнению с исходным уровнем, р<0,05).
В процессе проводимой терапии отмечены следующие побочные эффекты, возникавшие после приема аколата: боль в животе у одного ребенка, прибавка в весе у девочки с конституциональным ожирением.
У больной 14 лет, имевшей в анамнезе предменструальное обострение БА, признаки болезни значительно уменьшились после замены фликсотида пульмикортом турбухалером (возможно, определенное влияние на процесс альгодисменореи оказала терапия аколатом).
Таким образом, во всех случаях лечение аколатом способствовало повышению функциональных показателей легких, которое оказалось наиболее выраженным в случае его комбинации с иГк.
Нами также было показано, что иГк (но не аколат) влияют на содержание ИЛ-2 в крови у детей с БА (табл. 4) [3].
Так, концентрация ИЛ-2 в крови достоверно не отличалась от этого показателя у здоровых детей (третья группа), а также у больных БА, не принимавших иГк (вторая группа). Практически такой же уровень ИЛ-2 выявлен у детей со стабильной средней БА, принимавших иГк до начала терапии аколатом (первая группа). Однако через 1/2 месяца после отмены иГк на фоне лечения аколатом уровень ИЛ-2 в этой группе больных вырос почти в три раза по сравнению с тем же показателем у детей из второй группы, у которых наблюдалось обострение средней степени БА и которые принимали только аколат (статистически недостоверно) (табл. 4).
Известно, что Гк представляет собой мощные ингибиторы синтеза цитокинов: ИЛ-1, -3, -6, -8 [10]. Они тормозят также индукцию гена ИЛ-2, повышенная экспрессия мРНК которого выявлена в Т-лимфоцитах у стероидорезистентных астматиков [10]. В ряде работ показано снижение аффинности глюкокортикоидных рецепторов Т-клеток в присутствии высокой концентрации ИЛ-2 и ИЛ-4.
В исследовании [8] сочетанного приема бекотида и сингуляра отмечены достоверное повышение функциональных показателей легких и снижение количества эозинофилов крови по сравнению с группой больных, принимавших только иГк или антагонист Лт. Уже через несколько минут после внутривенного введения сингуляра отмечалось повышение ОФВ1 в среднем на 18%; таким образом, можно говорить о бронходилатирующей способности антилейкотриеновых препаратов [5]. О стероидосберегающем свойстве модификаторов Лт свидетельствует возможность значительного снижения (вплоть до отмены) дозы ингаляционных и системных Гк у больных тяжелой формой БА [2, 7, 11].
Сегодня использование антилейкотриеновых препаратов наряду с пролонгированными β2-агонистами и метилксантинами рассматривается как альтернативная возможность монотерапии средней и тяжелой формы БА удвоенными (повышенными) дозами иГк. Это особенно важно, если учесть тот факт, что доказан противовоспалительный эффект модификаторов Лт по сравнению с бронхолитиками длительного действия (серевентом, форадилом или теофиллином), которые in vivo не обладают такой достоверно выраженной способностью.
Предстоит на большом клиническом и экспериментальном материале изучить эффективность и безопасность использования антилейкотриеновых препаратов при лечении больных БА, а также особенности взаимодействия этих лекарственных средств с другими антиастматическими препаратами. Большое значение такая программа терапии имеет для педиатрии.
По вопросам литературы обращайтесь в редакцию
И. И. Балаболкин, доктор медицинских наук, профессор
Д. Ш. Мачарадзе, доктор медицинских наук
НИИ педиатрии НЦЗД РАМН, ДГП № 102, Москва